Los aldehídos son compuestos orgánicos que están formados por una cadena carbonada que tiene unido un grupo carbonilo (= C = O) terminal (localizado en un extremo de la molécula), que a su vez, está unido a un átomo de hidrógeno.
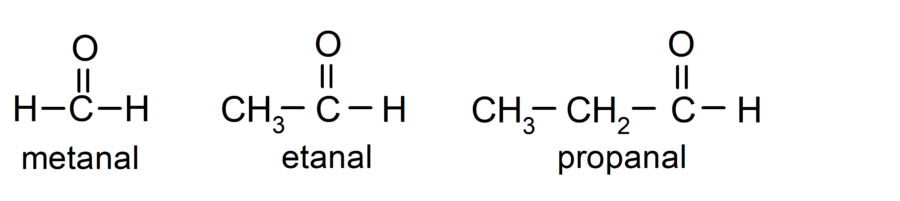
Son aldehídos muy comunes el metanal (formaldehído), el etanal (acetaldehído) y el propanal (propaldehído).
Algunos de estos compuestos están presentes en la naturaleza, por ejemplo, la vanilina o vainillina es un aldehído natural que constituye el saborizante principal de la vainilla.
- Ver además: Aldehídos y cetonas
Nomenclatura de los aldehídos
Los aldehídos se pueden nombrar utilizando las reglas de nomenclatura establecidas por la Unión Internacional de Química Pura y Aplicada (IUPAC).
Para nombrar un aldehído se utilizan prefijos que indican el número de átomos de carbono que tiene la cadena carbonada unida al grupo carbonilo. El grupo carbonilo siempre está ubicado en un extremo de la cadena carbonada, lo que significa que siempre tendrá posición uno y no es necesario indicar su localización en la cadena. Además, se coloca el sufijo -al al final del nombre del aldehído. Algunos ejemplos son:
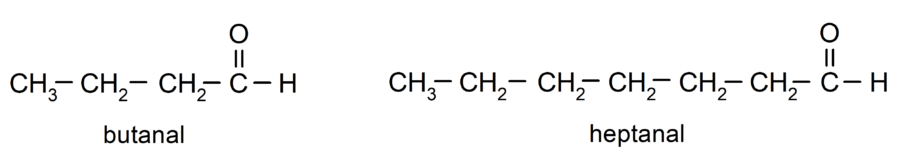
Si el aldehído es ramificado, es decir, que está constituido por varias cadenas carbonadas, se selecciona la cadena principal como la cadena que mayor cantidad de átomos de carbono tenga, y que además, contenga el grupo carbonilo. El resto de las cadenas se nombran como grupos sustituyentes.
Además, cada grupo sustituyente se debe elegir de manera que su posición ocupe la menor numeración posible en la cadena carbonada principal. Por otra parte, los átomos de carbono de la cadena principal se comienzan a contar por el extremo que contiene el grupo carbonilo. Algunos ejemplos son:
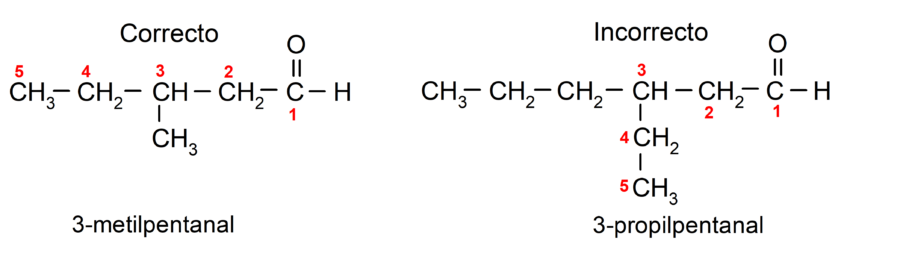
Si el aldehído actúa como sustituyente en la molécula, debido a que está formada también por grupos funcionales de mayor prioridad, como ácidos y ésteres, entonces el grupo aldehído se nombra como -oxo. Por ejemplo:
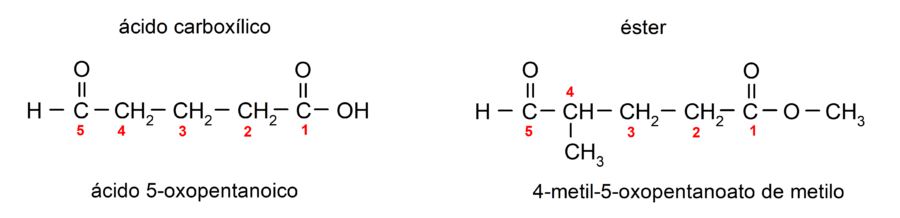
Si un aldehído tiene varios grupos carbonilos, se nombra utilizando prefijos que indican la cantidad de estos grupos, dial (dos grupos carbonilos), trial (tres grupos carbonilos), etc. Por ejemplo:
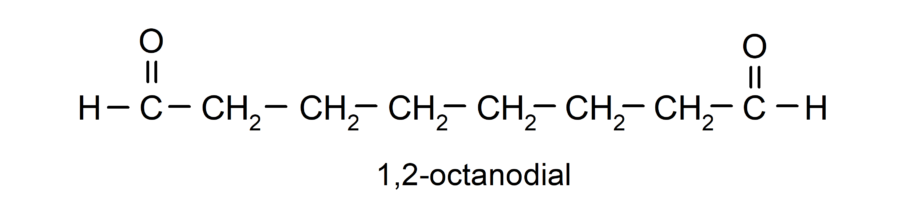
Cuando el grupo carbonilo está enlazado a un ciclo los aldehídos se nombran utilizando el término carbaldehído. Por ejemplo:
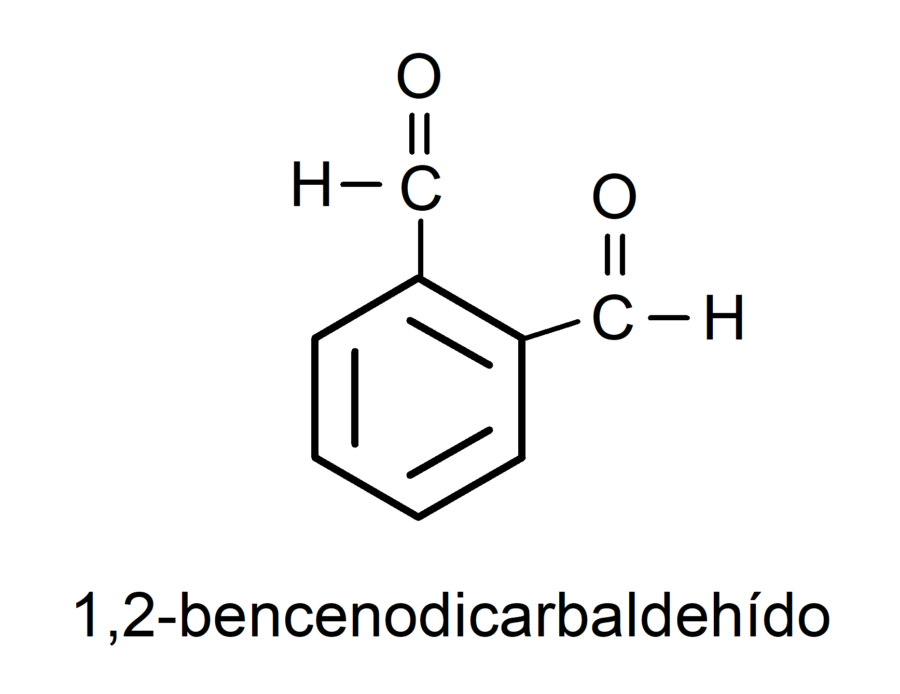
Propiedades físicas de los aldehídos
Los aldehídos suelen tener cierta variación de una misma propiedad física. Esto ocurre porque las propiedades físicas de los aldehídos dependen de cómo está formada la cadena carbonada que está unida al grupo carbonilo.
Algunas propiedades físicas de los aldehídos son:
- Solubilidad. La solubilidad en agua de los aldehídos depende de la cantidad de átomos que tiene la cadena carbonada. Los aldehídos de cadena carbonada más corta (hasta unos cinco átomos de carbono) son solubles en agua. Los aldehídos con cadenas carbonadas de muchos átomos de carbono no son solubles en agua. El metanal y el etanal son muy solubles en agua.
- Densidad. En general, los aldehídos son compuestos menos densos que el agua.
- Estados de agregación. Los aldehídos formados por uno y dos átomos de carbono son gases, los que contienen entre tres y doce átomos de carbono son líquidos, y los que están formados por más de doce átomos de carbono son sólidos.
- Olor. Algunos aldehídos tienen olores irritantes, mientras que otros tienen olores agradables.
- Polaridad. El grupo carbonilo les confiere polaridad.
- Punto de ebullición. Tienen puntos de ebullición mayores que los alcanos de peso molecular similar, y tienen puntos de ebullición menores que los ácidos carboxílicos y alcoholes de peso molecular comparable.
Propiedades químicas de los aldehídos
Algunas de las propiedades químicas de los aldehídos son:
Los aldehídos se oxidan cuando reaccionan con los reactivos de Tollens, Benedict y Fehling para formar el ácido carboxílico correspondiente. El ácido formado tendrá el mismo número de carbonos en la cadena carbonada que el aldehído a partir del que se formó. Por ejemplo:
- Oxidación con reactivo de Tollens (complejo de plata amoniacal en solución básica, [Ag(NH3)2]+). Esta reacción produce el ácido correspondiente y plata metálica.
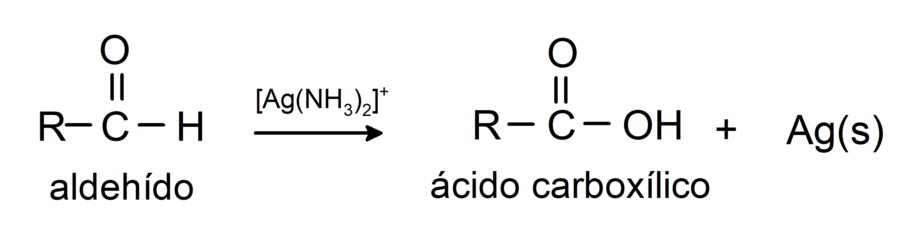
- Oxidación con reactivo de Benedict y Fehling (soluciones alcalinas de sulfato de cobre (II) (CuSO4) con composiciones diferentes). Esta reacción produce el ácido correspondiente y óxido cuproso (Cu2O).
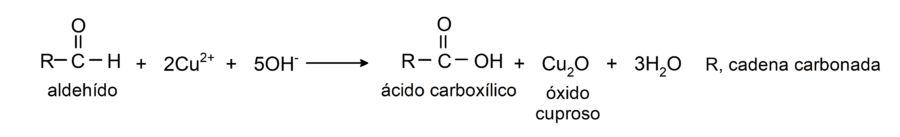
Experimentan reacciones de adición nucleofílica, donde se adicionan nucleófilos al grupo carbonilo de los aldehídos. Algunos ejemplos son:
- Reacciones de adición de alcoholes al grupo carbonilo de los aldehídos para formar acetales y hemiacetales.
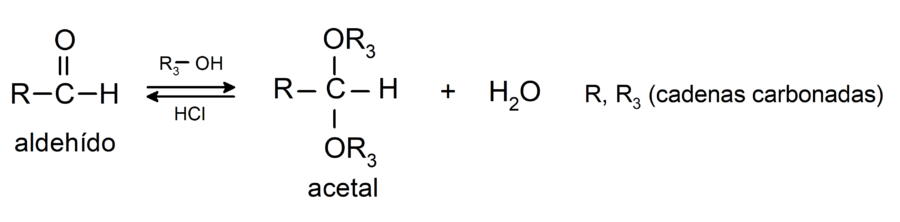
- Reacciones de adición de aminas primarias al grupo carbonilo.
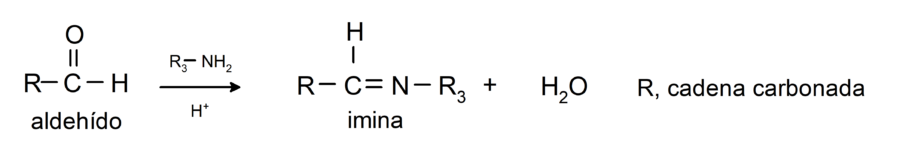
- Reacciones de adición de ácido cianhídrico (HCN), donde se forman cianhidrinas o cianohidrinas.
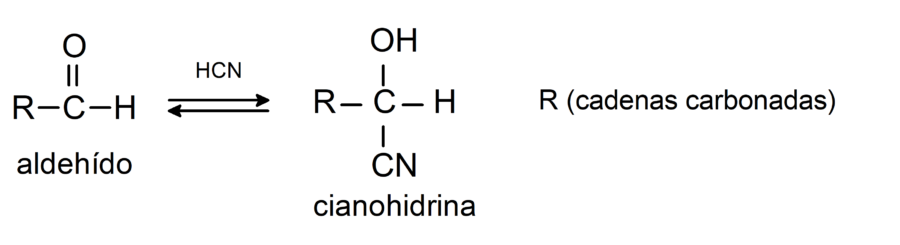
Experimentan reacciones de condensación aldólica. En este tipo de reacciones se condensan dos aldehídos para formar un aldol. Son reacciones que ocurren con hidróxido de sodio (NaOH). Por ejemplo:
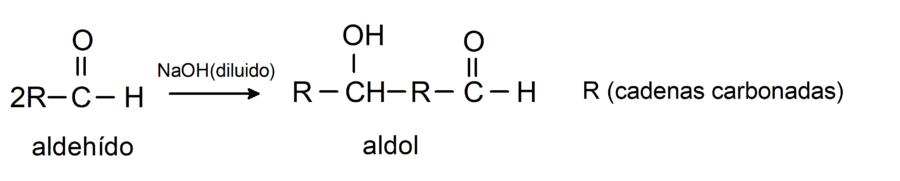
Experimentan reacciones de reducción a alcoholes primarios. En presencia de borohidruro de sodio (NaBH4) e hidruro de litio y aluminio (LiAlH4) o por hidrogenación catalítica, se reducen a alcoholes primarios. Por ejemplo:
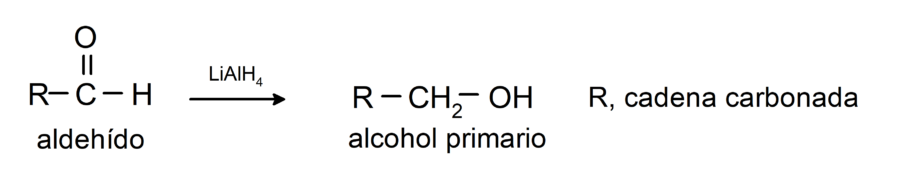
Ejemplos de aldehídos
- metanal (formaldehído)
- etanal (acetaldehído)
- propanal (propaldehído)
- butanal
- pentanal
- vainillina
- cinamaldehído
- propenal
- benzaldehído
- hexanal
- 3-bromociclopentanocarbaldehído
- ciclohexanocarbaldehído
- 4,4-dimetilpentanal
- 2-hidroxi-butanal
- 2-hidroxi-2-metil-butanal
- 2,3-dimetilpentanal
- pentanodial
- ciclopentanocarbaldehído
- isobutanal
- 2-cloro-butanal

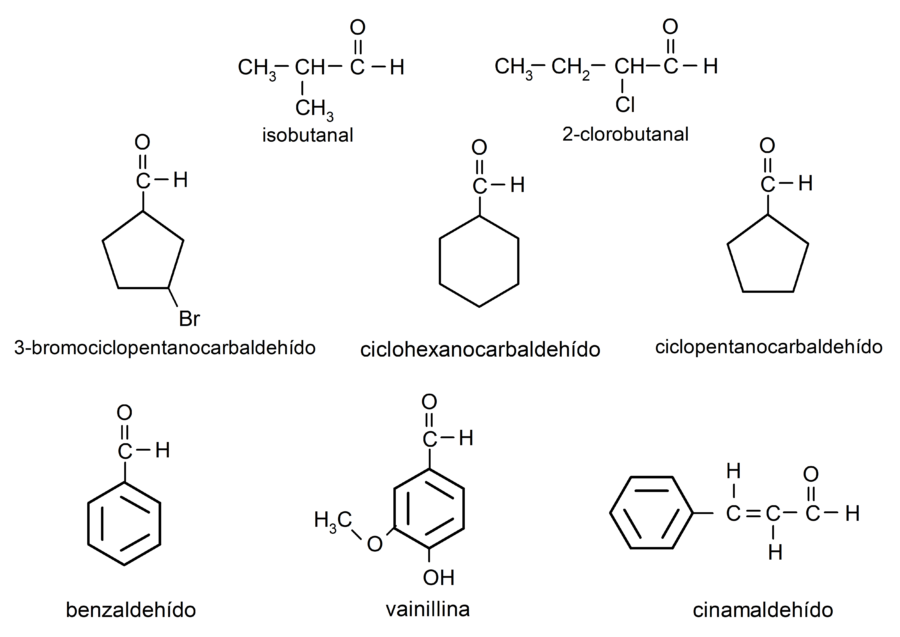
Aldehídos en la naturaleza
Algunos aldehídos presentes en la naturaleza son:
- El benzaldehído, un componente de las almendras.
- El cinamaldehído, componente que da olor a la esencia de canela.
- La vainillina, componente que da el sabor a la vainilla.
Por otra parte, una de las formas de la glucosa, la forma abierta, presenta un grupo funcional aldehído.
Se cree que el acetaldehído que se forma como intermedio en la metabolización del alcohol provoca los síntomas de la resaca cuando se produce estado de embriaguez por ingesta de alcohol.
Usos de los aldehídos
Algunos de los usos principales de los aldehídos son:
- Se utilizan en la producción de solventes, pinturas, productos cosméticos y esencias.
- Se usan en la fabricación de resinas. La baquelita se fabrica con formaldehído y es una resina que funciona muy bien como aislante eléctrico.
- Se han utilizado como sedantes. El paraldehído se ha usado como sedante e hipnótico, aunque ahora está en desuso debido a su olor desagradable.
- Se emplean como conservantes de muestras biológicas y cadáveres. El formaldehído es muy utilizado en este sentido.
- Se emplean como aromatizantes de alimentos. Un ejemplo es la vainillina, que se utiliza dar a los postres aroma a vainilla.
- Se usan como agentes desinfectantes.
Peligros de los aldehídos
Varios aldehídos han sido considerados cancerígenos, por ejemplo, el formaldehído ha sido declarado un compuesto cancerígeno según la OMS (Organización Mundial de la Salud).
La exposición y el contacto con muchos aldehídos provoca irritación en la piel, en los ojos y en el tracto respiratorio. Por otro lado, provoca dermatitis de contacto y enfermedades hepáticas.
Referencias
- Solomons, T.W. Graham e María Cristina Sangines Franchini (1985). “Química orgánica” México, D.F.: Limusa.
- Whitten, K. W., Gailey, K. D., Davis, R. E., de Sandoval, M. T. A. O., & Muradás, R. M. G. (1992). “Química general” (pp. 108-117). McGraw-Hill.
- Arteaga, P. M. (2017). “Cetonas y aldehídos” Con-Ciencia Boletín Científico de la Escuela Preparatoria No. 3, 4(8).
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)