Los alcanos son una clase de hidrocarburos que están formados por un número variable de átomos de carbono que se unen entre sí por enlaces simples, a modo de esqueleto. A su vez, cada átomo de carbono se une a átomos de hidrógeno, que eventualmente pueden estar sustituidos por otros átomos o grupos funcionales. Por ejemplo: cloroformo, metano, octano.
La fórmula molecular de los alcanos de cadena lineal abierta es CnH2n+2: C representa al carbono, H al hidrógeno y n al número de átomos de carbono. Los alcanos son hidrocarburos saturados, lo que significa que no tienen enlaces dobles o triples. Para nombrarlos, se utiliza el sufijo “-ano”, luego de nombrar la cadena carbonada utilizando el prefijo correspondiente a la cantidad de átomos de carbono (et- (2), pro- (3), but- (4), pen- (5), hex- (6), hep- (7)).
Puede servirte:
Clasificación de los alcanos
Dentro de los alcanos se suelen reconocer dos grandes grupos: los de cadena abierta (también llamados acíclicos) y los de cadena cerrada (o cíclicos).
Cuando los compuestos de cadena abierta no presentan ninguna sustitución de los hidrógenos que acompañan a cada átomo de carbono, reciben el nombre de alcanos lineales y son los alcanos más simples. Cuando presentan alguna sustitución de alguno de sus hidrógenos por una o varias cadenas carbonadas, reciben el nombre de alcanos ramificados. Los sustituyentes más comunes son los grupos etilo (CH3CH2-) y metilo (CH3-).
Por su parte, existen compuestos con un único ciclo en la molécula (monocíclicos) y otros con varios (policíclicos). Los alcanos cíclicos pueden ser homocíclicos (se forman con la intervención exclusiva de átomos de carbono) o heterocíclicos (en los que participan otros átomos, por ejemplo, oxígeno o azufre).
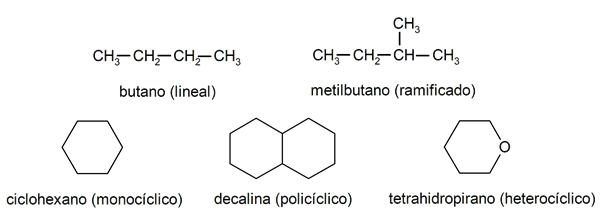
Propiedades físicas de los alcanos
En general, las propiedades físicas de los alcanos están condicionadas por la masa molecular (a su vez vinculada con la longitud de la cadena carbonada).
- Estado de agregación. Los alcanos de menor número de carbonos son gaseosos a temperatura ambiente, los que van desde los 5 hasta los 18 átomos de carbono son líquidos y por encima de 18 átomos son sólidos (semejantes a la cera).
- Relación con el agua. Al ser menos densos que el agua, los alcanos tienden a flotar sobre ella, en general, son insolubles en agua y solubles en disolventes orgánicos.
- Punto de ebullición y fusión. El punto de ebullición y de fusión de los alcanos depende de su masa molecular, es decir, de la longitud de la cadena carbonada, aunque también depende muchas veces de la disposición espacial de los átomos. Los alcanos lineales y los cíclicos tienen mayor punto de ebullición que los ramificados.
Propiedades químicas de los alcanos
Algunas de las principales propiedades químicas de los alcanos son:
- Son compuestos químicos de muy escasa reactividad, razón por la cual también se los conoce como “parafinas” (en latín, parum affinis significa “poca afinidad”).
- Son compuestos que tienen una energía de activación muy alta cuando están involucrados en reacciones químicas. La reacción más importante que pueden experimentar es la combustión y generan, en presencia de oxígeno, calor, dióxido de carbono y agua.
- Son la base de una variedad importante de reacciones asociadas a procesos industriales importantísimos, siendo los combustibles más tradicionales.
- Aparecen como productos finales de procesos biológicos como la fermentación metanogénica que realizan algunos microorganismos.
Ejemplos de alcanos
- Triclorometano (CHCl3)
- Metano (CH4)
- Etano (C2H6)
- Propano (C3H8)
- Butano (C4H10)
- Octano (C8H18)
- Hexano (C6H14)
- Icosano (C20H42)
- Pentano (C5H12)
- n-heptano (C7H16)
- 2-metilbutano (C5H12)
- 3-cloro-4-n-propilheptano (C10H21Cl)
- 1-bromo-2-feniletano (C8H9Br)
- 3-etil-4-metilhexano (C9H18)
- cubano (C8H8)
- 1-bromopropano (C3H7Br)
- 3-metil-5-n-propiloctano (C12H26)
- 3,3-dimetildecano (C12H26)
- Ciclopropano (C3H6)
- 3-etil-2,3-dimetilpentano (C9H20)
Los alcanos en la vida cotidiana
Algunos de los principales usos de los alcanos son:
- Cloroformo (triclorometano). Los vapores de esta sustancia solían usarse como anestésicos, pero luego se prohibieron porque se descubrió que dañan órganos vitales, como el hígado y los riñones. En la actualidad se utiliza al triclorometano como disolvente y refrigerante.
- Metano. Es el alcano más simple y está compuesto por un átomo de carbono y cuatro de hidrógeno. Se trata de un gas que se produce de forma natural, por la descomposición de diferentes sustratos orgánicos, y es el principal componente del gas natural que se usa para producir electricidad. El metano también es usado en la industria química y es uno de los gases que más aporta al efecto invernadero.
- Etano. Es un alcano que se utiliza para la producción de etileno (compuesto muy usado en la industria), para generar energía y en la producción de plásticos y detergentes.
- Propano. Es un gas que se usa como combustible eléctrico en hogares e industrias. Se emplea para calefaccionar ambientes, calentar agua y en hornos y cocinas. Además, es usado como carburante para vehículos.
- Octano. Es un alcano de ocho carbonos y tiene gran importancia porque determina la calidad final de las naftas. Esta calidad se mide por el índice de octanos u octanaje del combustible, que toma como referencia a uno poco detonante (índice 100) y a otro muy detonante (índice 0).
- Hexano. Es un importante disolvente y, debido a su elevada toxicidad, no se lo utiliza con frecuencia.
- Butano. Junto con el propano (C3H8), conforman los denominados gases licuados del petróleo (GLP), que se forman en las bolsas de gas durante los procesos de extracción del petróleo. Actualmente, se está promoviendo el reemplazo de la nafta o el diesel por GLP ya que se trata de un hidrocarburo más amigable con el medio ambiente.
- Pentano. Es un alcano líquido que se usa como disolvente y forma parte de algunas gasolinas.
- Icosano. Es el alcano de veinte carbonos (el prefijo ‘ico’ significa veinte) y suele usarse en la fabricación de cosméticos y lubricantes.
- Ciclopropano. Es un alcano que antiguamente se usaba como anestésico, pero fue reemplazado por otras sustancias.
- n-heptano. Es un alcano que se toma como referencia para el punto cero de la escala de octanaje de las naftas, que sería lo menos deseable, ya que arde de manera explosiva. Se obtiene de la resina de ciertas plantas y es usado como disolvente. También es utilizado en la industria petrolera y, en menor medida, como combustible.
- 3-etil-2,3-dimetilpentano. Es un compuesto que se usa como disolvente y como componente de la gasolina.
- 2-metilbutano. Es un compuesto líquido y altamente inflamable, también denominado isopentano, que suele usarse como disolvente, para la fabricación de plásticos y en la industria química.
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)