Las amidas son compuestos químicos orgánicos derivados de los ácidos carboxílicos, en donde el grupo hidroxilo (-OH) del grupo carboxilo (-COOH) del ácido es sustituido por un grupo amino (-NH2, -NH-R, -N-(R)2, siendo R una cadena carbonada cualquiera).

Las amidas son moléculas orgánicas que contienen el grupo amida, que está formado por un grupo carbonilo y un grupo amino. Por ejemplo: la etanamida, la propanamida y la N-metil-etanamida.
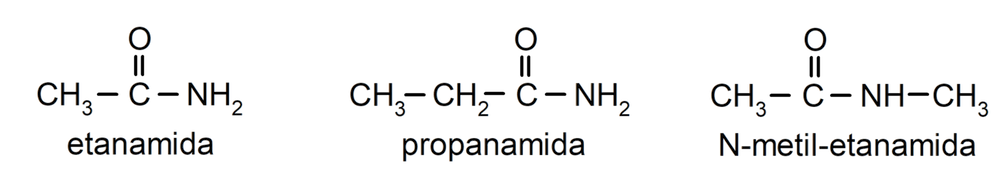
- Ver además: Aldehídos y cetonas
Tipos de amidas
Las amidas se pueden clasificar según la cantidad de hidrógenos (que están unidos al nitrógeno del grupo amino) que han sido sustituidos por distintos grupos sustituyentes. En este sentido existen amidas primarias, secundarias y terciarias.
- Amidas primarias. Son amidas que no tienen sustituidos los hidrógenos del grupo amino. Por ejemplo:
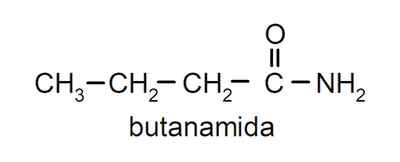
- Amidas secundarias. Son amidas que tienen sustituidos uno de los hidrógenos del grupo amino. Por ejemplo:
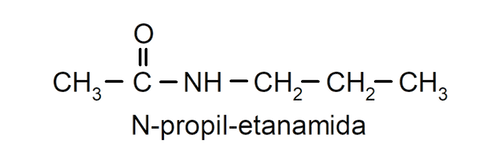
- Amidas terciarias. Son amidas que tienen sustituidos dos de los hidrógenos del grupo amino. Por ejemplo:
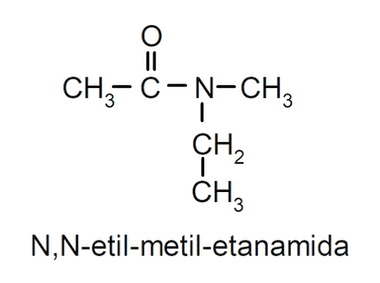
Nomenclatura de las amidas
Según la nomenclatura común, las amidas se nombran como derivados de ácidos carboxílicos siguiendo las siguientes reglas:
- Se ubica en la posición 1 el carbono correspondiente al grupo carbonilo y a partir de este carbono se elige la cadena carbonada más larga. Por ejemplo:
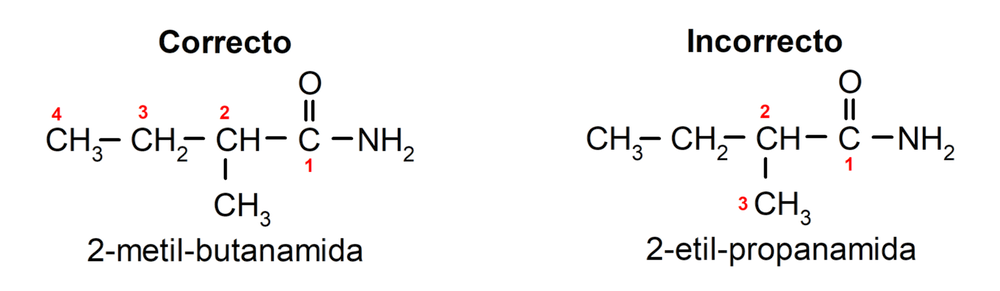
- Las amidas primarias se nombran utilizando el prefijo correspondiente a la cantidad de átomos de carbono del ácido carboxílico que les dio origen. Por ejemplo:
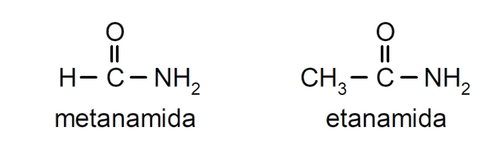
Según la Unión Internacional de Química Pura y Aplicada (IUPAC), las aminas se nombran utilizando las siguientes reglas:
- Las amidas secundarias y terciarias se nombran utilizando el prefijo correspondiente a la cantidad de átomos de carbono del ácido carboxílico que les dio origen. Además, por cada hidrógeno del grupo amino que se haya sustituido se coloca una N. Así, se nombran los distintos sustituyentes indicando su cantidad y al final del nombre se coloca la palabra amida. Por ejemplo:
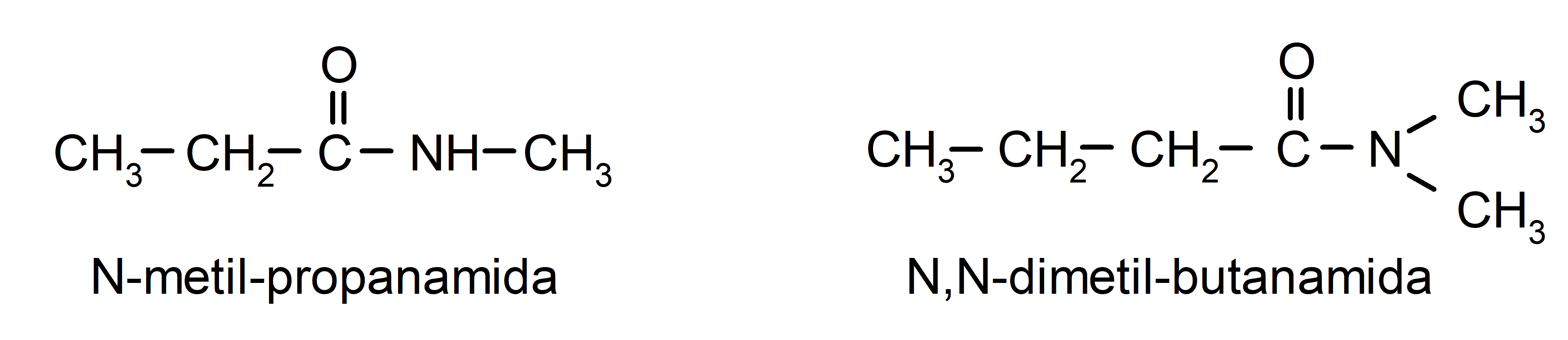
- Cuando la molécula tiene grupos prioritarios respecto al grupo amida, entonces la amida se nombra como sustituyente. En estos casos el grupo amida se nombra como carbamoíl. Por ejemplo:

- Cuando la molécula está formada por un ciclo y un grupo amida, se toma el ciclo como cadena principal y se coloca el sufijo -carboxamida. Por ejemplo:
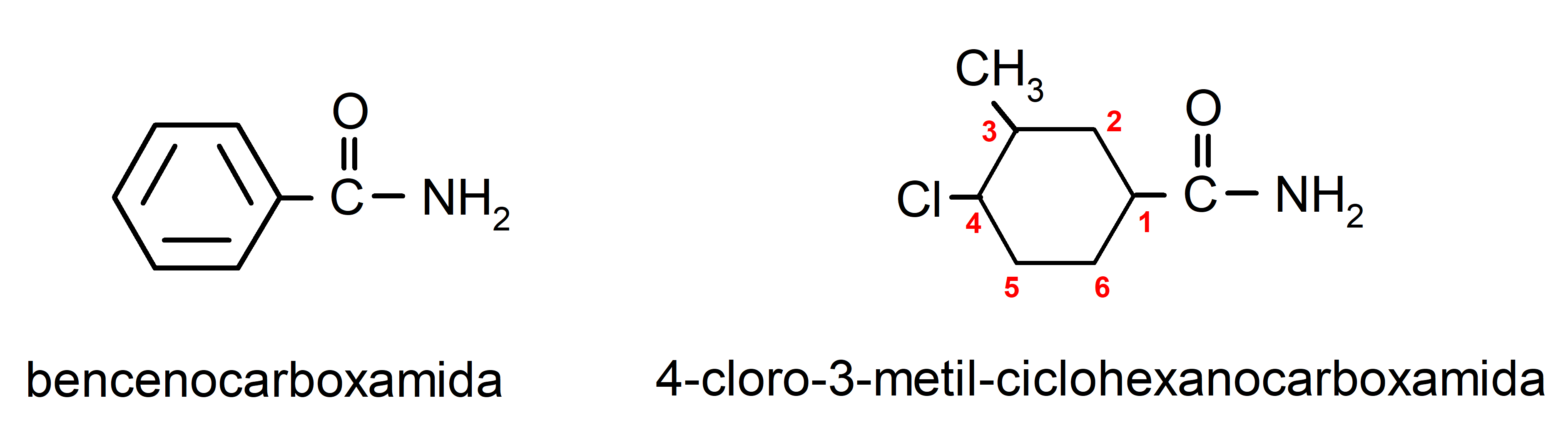
Propiedades físicas de las amidas
- Las amidas son sólidas a temperatura ambiente, con excepción de la metanamida.
- Tienen puntos de ebullición elevados, incluso más elevados que los de los ácidos carboxílicos correspondientes.
- Las amidas son buenos disolventes.
- Son bases débiles.
Reacciones químicas de las amidas
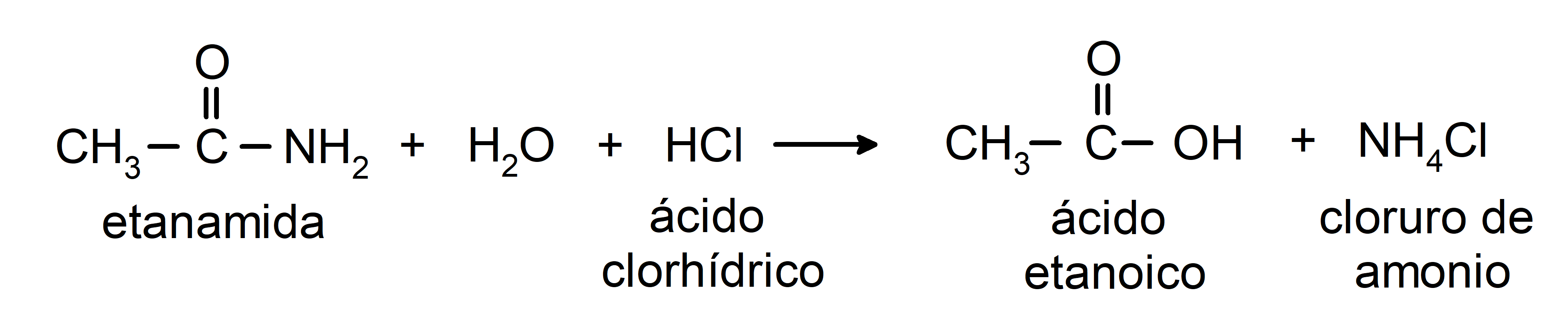
- Las amidas reaccionan con un ácido acuoso para formar el ácido carboxílico correspondiente y una sal de amonio. Por ejemplo:
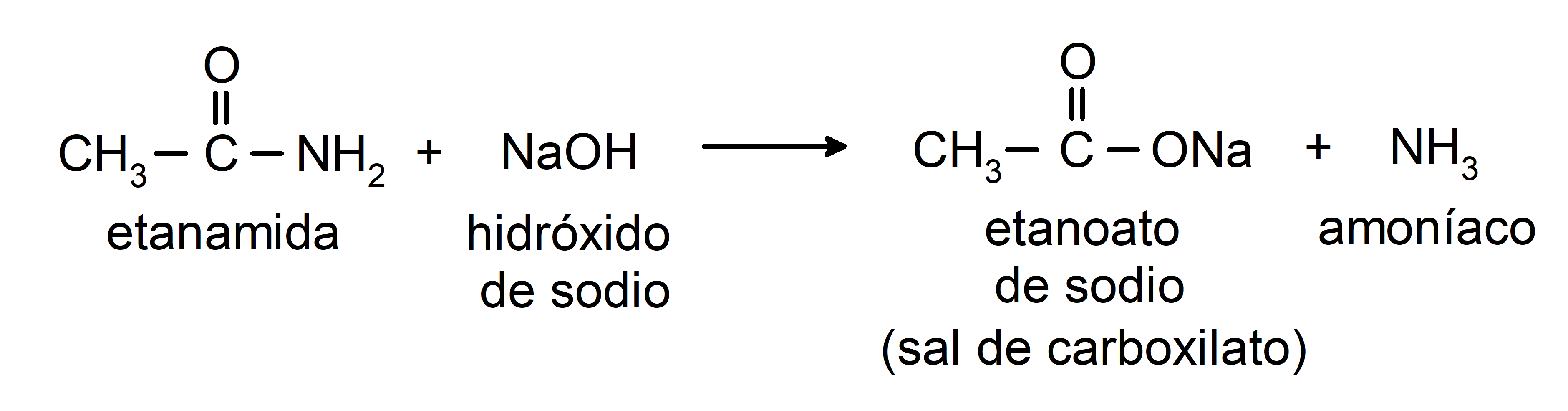
- Las amidas reaccionan con álcali para formar el ácido carboxílico correspondiente y una sal de carboxilato. Por ejemplo:
- Las amidas se reducen a aminas en presencia de tetrahidruro de litio y aluminio:
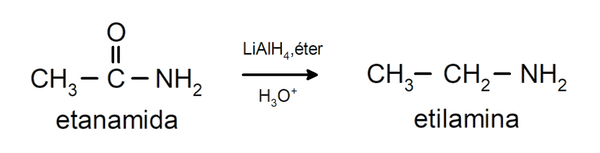
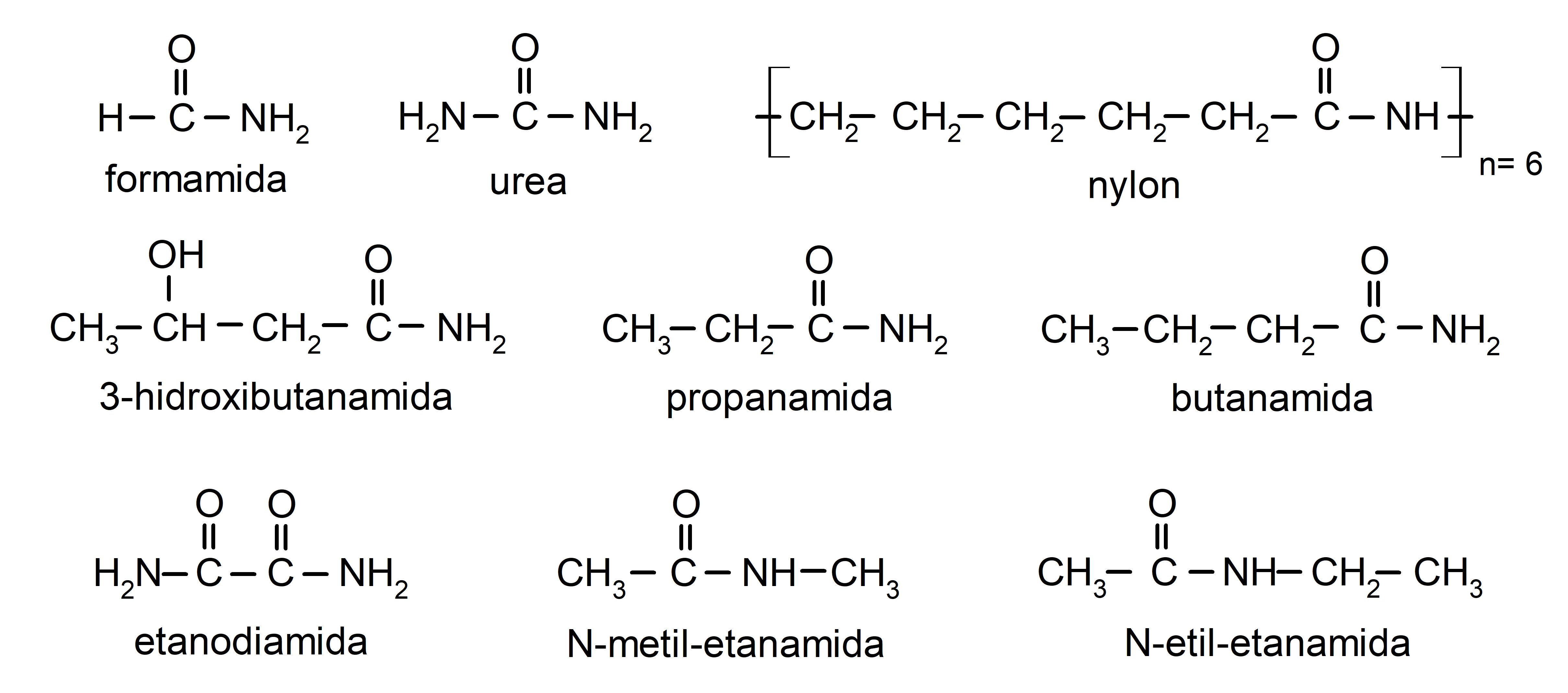
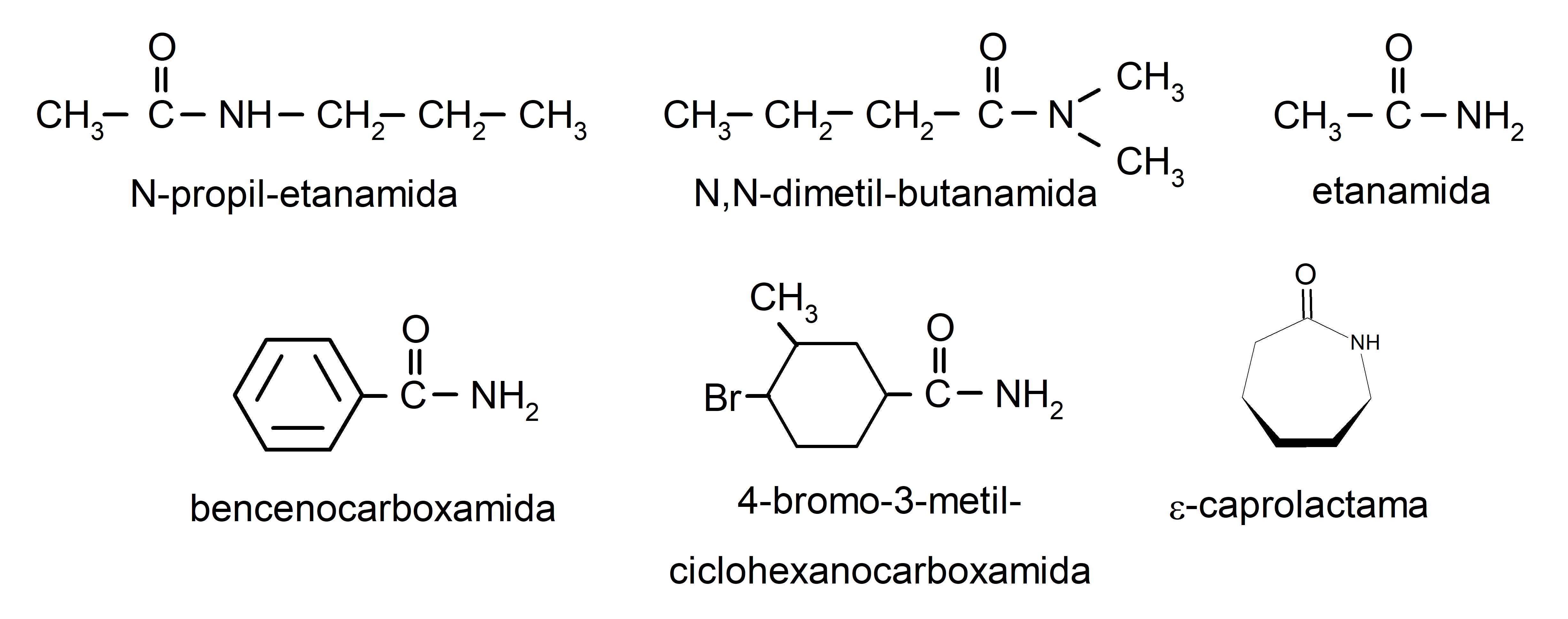
Ejemplos de amidas
- formamida
- urea
- nylon
- ε-caprolactama
- etanamida
- propanamida
- butanamida
- etanodiamida
- N-metil-etanamida
- N-etil-etanamida
- N-propil-etanamida
- N,N-dimetil-butanamida
- bencenocarboxamida
- 4-bromo-3-metil-ciclohexanocarboxamida
- 3-hidroxibutanamida
Usos de las amidas
Las amidas son muy utilizadas en la industria farmacéutica. Además, se utilizan como componentes de desmolde en la industria del plástico. Por otro lado, se emplean como emulsificantes, como surfactantes y como disolventes. Por ejemplo, la urea es una amida que se emplea ampliamente en la industria farmacéutica y en la industria del nylon.
Referencias
- Ramírez-Barrón, S. N., Sáenz-Galindo, A., López-López, L., & Cantú-Sifuentes, L. (2013). Amidas, Aplicación y Síntesis. Revista Científica de la Universidad Autónoma de Coahuila, 5(9).
- Caglieri, S. C., & Pagnan, M. (2013). Estudio teórico sobre la hidrólisis ácida de amidas alifáticas y aromáticas. Información tecnológica, 24(3), 35-40.
- Martinez, C. H. M., Gomez, L. Y. P., de Escobar, M. S., & Escalante, F. A. (2002). Química orgánica. Universidad de Las Palmas de Gran Canaria, Vicerrectorado de Estudios y Calidad Docente.
Sigue con:





¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)