Se llama base química a toda aquella sustancia que al disolverse en agua libera iones hidroxilo (OH–). Por ejemplo: hidróxido de calcio, hidróxido de cobre, hidróxido de zinc.
Las bases químicas también se conocen como álcalis, porque al disociarse y liberar los grupos hidroxilos (OH–), el pH de las soluciones aumenta, es decir, la solución se alcaliniza. Esto es contrario a lo que sucede cuando se disuelve un ácido, pues en ese caso el pH disminuye y la solución se acidifica.
Las bases tienen un sabor amargo característico. Tras su disolución, las soluciones resultantes conducen la corriente eléctrica (por la presencia de iones) y suelen ser cáusticas e irritantes para la piel y demás tejidos humanos y animales.
Las bases neutralizan a los ácidos, a menudo formando sales. Las soluciones alcalinas tienden a percibirse como resbaladizas o jabonosas; esto sucede porque producen inmediatamente la saponificación de las grasas presentes en la superficie de la piel.
En el caso de los hidróxidos su solubilidad depende del metal: los del grupo (I) son los más solubles en agua, en cambio, los hidróxidos de los elementos con grado de oxidación (II) son menos solubles y los de grado de oxidación (III) o (IV) son casi insolubles. Las aminas y las bases de los ácidos nucleicos son las bases más difundidas entre las orgánicas.
- Puede servirte: Antiácidos
Teorías que definen las bases
Existen distintas teorías para definir a las bases químicas:
- La teoría de Arrhenius. Establece que una base es una sustancia que cuando se disuelve en agua libera iones OH–. El inconveniente de esta teoría es que está basada en que la sustancia debe estar en disolución acuosa y contener OH– como parte de su estructura. Por esta razón, algunas bases como el amoníaco (NH3), que no tienen OH–, no se podían explicar a través de esta teoría. Por ejemplo, según Arrhenius, sustancias básicas son el hidróxido de sodio (NaOH) y el hidróxido de potasio (KOH).
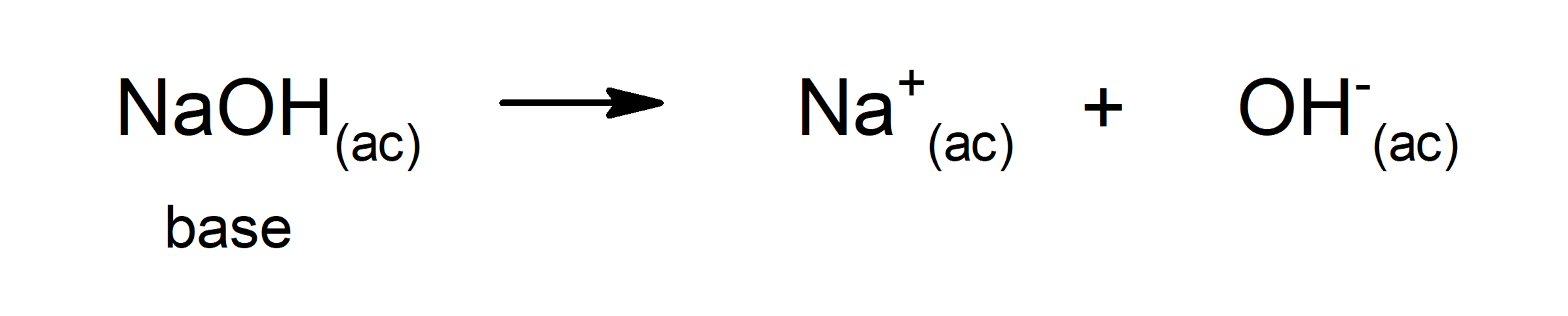
- La teoría de Brönsted y Lowry. Define a una base como una sustancia que capta cationes H3O+ (H+) y que además está involucrada con su ácido conjugado, que es la sustancia que cede los cationes H+ que capta la base. Esta teoría resuelve el inconveniente de la teoría de Arrhenius sobre la necesidad de que las sustancias definidas como bases estén en medio acuoso ya que, según Brönsted y Lowry, las bases se definen en cualquier solvente. Por ejemplo, algunas bases definidas por Brönsted y Lowry son el amoníaco (NH3) y el bisulfuro (HS–).
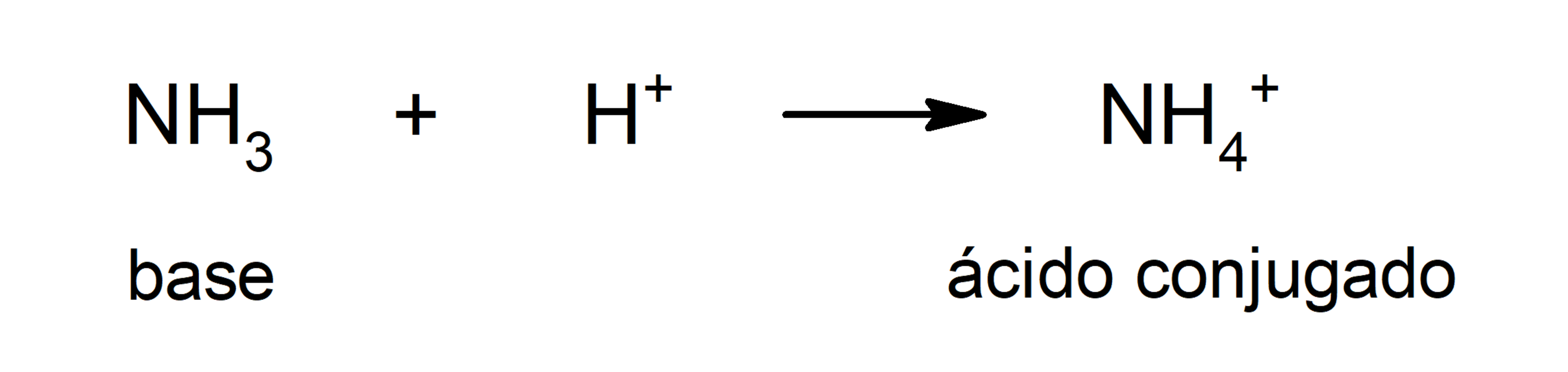
- La teoría de Lewis. Denomina a una base como una sustancia que puede donar un par de electrones. Por ejemplo, el ion OH– y la molécula de amoníaco (NH3) son bases según la definición de Lewis, ya que tienen un par de electrones no enlazantes que pueden donar. Una reacción ácido-base, según esta teoría, se puede representar como:

Así, el ion OH– dona su par de electrones no enlazante al H+ para formar un enlace coordinado o dativo (es un tipo de enlace covalente donde solo uno de los átomos que forman el enlace aporta el par de electrones) mediante el que se forma molécula de agua.
Usos de las bases químicas
El hidróxido de sodio es muy utilizado en la industria: es la llamada soda cáustica. En la fabricación del jabón se emplean grasas animales o vegetales, que se hierven con hidróxido de sodio y, de esa manera, se forma estearato sódico.
También se usa el hidróxido de sodio en la fabricación de limpiadores de hornos, en la fabricación de la pulpa de papel y de algunos limpiadores domésticos. Otra base muy usada es el hidróxido de calcio, que es la cal apagada que se usa en la construcción.
Ejemplos de bases químicas
- Hidróxido de calcio – Ca(OH)₂
- Hidróxido de potasio – KOK
- Hidróxido de bario – Ba(OH)₂
- Hidróxido de magnesio – Mg(OH)₂
- Amoníaco – NH₃
- Hidróxido de cobre (II) – Cu(OH)₂
- Hidróxido de hierro (II) – Fe(OH)₂
- Hidróxido de aluminio – AI(OH)₃
- HIdróxido de zinc – Zn(OH)₂
- Hidróxido de sodio – NaOH
- Hidróxido de níquel (II) – Ni(OH)₂
- Jabón detergente

- Sigue con: Hidrácidos
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)