Muchos compuestos químicos están integrados por moléculas que, a su vez, están compuestas por átomos. Para formar las moléculas, los átomos se unen mediante la formación de enlaces químicos.
Los enlaces químicos no son todos iguales: básicamente dependen de las características electrónicas de los átomos involucrados, de sus valores de electronegatividad, entre otros factores. Los tipos de enlace más comunes son: los enlaces iónicos y los enlaces covalentes.
Los enlaces covalentes se forman entre átomos no metálicos del mismo elemento químico, entre átomos no metálicos de distintos elementos con una diferencia de electronegatividad menor o igual que 1,7 y entre un no metal y el hidrógeno. Por ejemplo: dicloro, oxígeno molecular, agua.
El enlace covalente se forma cuando dos de estos átomos comparten los electrones de su último nivel de energía para cumplir la Regla del Octeto, que establece que los iones de los distintos elementos químicos que se encuentran en la Tabla Periódica tienden a completar sus últimos niveles de energía con 8 electrones, por lo que las moléculas pueden adquirir una estabilidad semejante a la de los gases nobles.
Por eso, la forma en que estas sustancias o compuestos químicos logran la estabilidad es compartiendo un par de electrones (uno procedente de cada átomo). De esta manera, el par de electrones compartido es común a los dos átomos y al mismo tiempo los mantiene unidos.
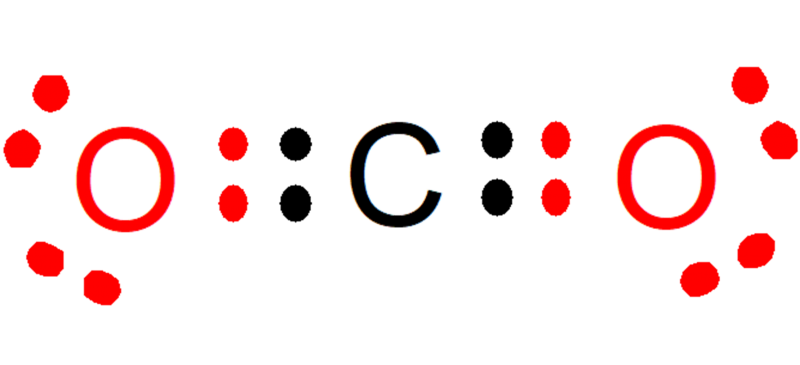
Por ejemplo, en el dióxido de carbono (CO2), cada oxígeno aporta dos electrones (color rojo) al enlace con el carbono, mientras que el carbono aporta dos electrones (color negro) a cada enlace con cada oxígeno. En el compuesto formado quedan 8 electrones sobre cada átomo, y así se cumple la Regla del Octeto.
- Puede servirte: Enlace metálico
Tipos de enlaces
Existen fundamentalmente tres tipos de enlaces covalentes, aunque es importante aclarar que ningún enlace es absolutamente covalente o absolutamente iónico. Todos los enlaces tienen cierto porcentaje de covalente y iónico, de hecho, a veces se considera el enlace iónico como una “exageración” del enlace covalente. En este sentido se pueden presentar los siguientes tipos de enlace covalente:
- Enlace covalente polar. Se forma entre átomos de distintos elementos químicos que tengan una diferencia de electronegatividad superior a 0,4. Los electrones del enlace son más atraídos por el átomo más electronegativo, y queda así una densidad de carga negativa sobre este átomo y una densidad de carga positiva sobre el átomo menos electronegativo. Debido a la distinta distribución de carga sobre la molécula, se genera un dipolo eléctrico. Por ejemplo: el enlace oxígeno-hidrógeno.
- Enlace covalente apolar. Se forma entre átomos del mismo elemento químico o entre átomos con una diferencia de electronegatividad prácticamente despreciable. Por ejemplo: el enlace carbono-hidrógeno.
- Enlace covalente coordinado o dativo. Es un enlace covalente donde solo uno de los átomos que forman el enlace aporta el par de electrones compartido. Por lo general, para que se forme este tipo de enlace, uno de los átomos involucrados debe tener al menos un par de electrones libres (como en el caso del nitrógeno). Por ejemplo: el enlace que se forma entre el nitrógeno y el hidrógeno en el ión amonio (NH4+).
Sustancias compuestas por moléculas covalentes
Las sustancias que contienen moléculas covalentes pueden presentarse en cualquier estado de la materia (sólido, líquido o gaseoso) y, en general, son malas conductoras del calor y de la electricidad.
Existen sustancias covalentes moleculares y sustancias covalentes reticulares. Las covalentes moleculares tienen puntos de ebullición y fusión bajos, son solubles en solventes apolares (como benceno o tetracloruro de carbono) y en estado sólido son blandas. Las covalentes reticulares forman redes cristalinas, por lo que tienen puntos de fusión y ebullición más elevados y son sólidos duros e insolubles.
Ejemplos de enlaces covalentes
Se pueden dar numerosos ejemplos de compuestos o sustancias que contienen enlaces covalentes:
- Diflúor
- Dibromo
- Dicloro
- Diyodo
- Oxígeno molecular
- Agua
- Amoníaco
- Dióxido de carbono
- Metano
- Propano
- Glucosa
- Nitrógeno molecular
- Cuarzo
- Parafina
- Diésel

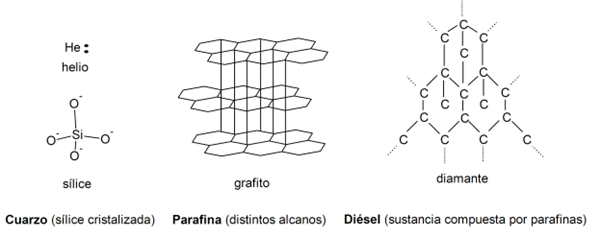
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)