Los elementos químicos son un tipo de materia que por ningún procedimiento o reacción química pueden reducirse o descomponerse en otros elementos más sencillos. Por esta razón, se puede decir que un elemento es toda materia conformada por átomos de una misma y única clase, es decir, átomos que tienen el mismo número atómico (igual número de protones), aunque tengan distinta masa atómica. Por ejemplo: azufre, boro, cromo, estaño.
La primera definición de elemento químico fue introducida por Lavoisier en el Traité Élémentaire de Chimie, en 1789. Allá por el siglo XVIII, Lavoisier subdividió a las sustancias simples en cuatro grupos:
- Elementos de los cuerpos
- Sustancias no metálicas oxidables y acidificables
- Sustancias metálicas oxidables y acidificables
- Sustancias salidificables térreas
- Puede servirte: Compuestos químicos
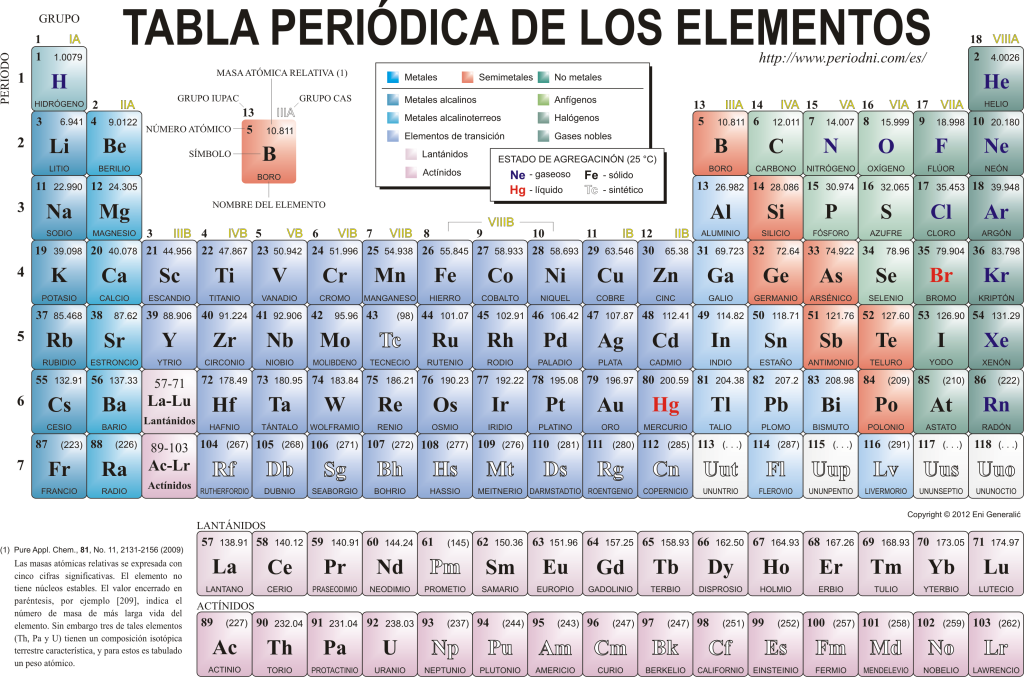
Tabla periódica de los Elementos
Hoy se conocen 118 elementos químicos. Todos se reúnen, clasifican y organizan según muchas de sus propiedades en un esquema gráfico conocido como Tabla Periódica de los Elementos, que fue originalmente creada por el químico ruso Dimitri Mendeleyev en 1869. La Tabla Periódica está compuesta por 18 grupos (columnas) y 7 períodos (filas), en los que están ubicados los elementos químicos.
Los principales grupos que se pueden encontrar en esta tabla son:
Los metales alcalinos (Grupo 1), los metales alcalinotérreos (Grupo 2), la familia del escandio, que incluye las tierras y los actínidos (Grupo 3), la familia del titanio (Grupo 4), la familia del vanadio (Grupo 5), la familia del cromo (Grupo 6), la familia del manganeso (Grupo 7), la familia del hierro (Grupo 8), la familia del cobalto (Grupo 9), la familia del níquel (Grupo 10), la familia del cobre (Grupo 11), la familia del zinc (Grupo 12), elementos térreos (Grupo 13), elementos carbonoideos, en este grupo está el carbono, que constituye la base de la vida en la Tierra (Grupo 14), elementos nitrogenoideos (Grupo 15), elementos anfígenos, incluye al oxígeno, elemento fundamental para la respiración de los seres vivos (Grupo 16), elementos halógenos (Grupo 17) y gases nobles (Grupo 18).
Muchos de estos elementos tienen isótopos estables o radiactivos, es decir, un mismo elemento químico, por ejemplo, el hidrógeno (H), puede tener varios isótopos (1H, 2H, 3H). Esto significa que cada átomo isótopo tiene el mismo número de protones (lo que implica que pertenece al mismo elemento químico) y distinto número de neutrones.
Algunos isótopos no son estables (radiactivos), o sea, se desintegran en un determinado tiempo, emitiendo ciertas partículas (neutrones, fotones, partículas alfa, entre otras) y generan otros isótopos estables o también radiactivos. Los elementos químicos tienen propiedades como el punto de ebullición y el de fusión, la electronegatividad, la densidad y el radio iónico, entre otras. Estas propiedades son importantes porque permiten predecir su comportamiento, reactividad, etc.
- Sigue en: Tabla Periódica
¿Cómo se presentan los elementos en la Tabla Periódica?
Cada elemento químico aparece caracterizado en la Tabla Periódica utilizando cierta simbología. En primer lugar, en el centro de cada recuadro resalta en grande su símbolo universal, que consta de una o dos letras (por convención, si son dos las letras, la primera se escribe en mayúscula y la siguiente en minúscula).
Arriba y a la izquierda aparece en tipografía pequeña su número atómico, que es el que señala la cantidad de protones que tiene dicho elemento. Debajo del símbolo del elemento aparece su nombre y arriba, a la izquierda, aparece su masa atómica relativa. Además, el color en que está representado el símbolo del elemento significa su estado de agregación (según la representación que se utilice en cada Tabla Periódica).
Los diferentes elementos presentan radios atómicos variables y, a medida que aumenta el número de protones del núcleo, mayor es la atracción que el núcleo ejerce sobre los electrones, por lo que el radio atómico tiende a disminuir. Cuando el radio atómico es pequeño, los electrones del nivel más externo de la nube están muy atraídos por el núcleo, por lo que no se ceden con facilidad. Lo contrario sucede con los elementos de radios atómicos elevados: ceden sus electrones externos fácilmente.
Así, el radio atómico aumenta de arriba hacia abajo cuando recorremos los grupos de la Tabla Periódica y disminuye de izquierda a derecha a medida que recorremos sus períodos.
Ejemplos de elementos químicos
| Elemento químico | Símbolo |
| Actinio | Ac |
| Aluminio | Al |
| Americio | Am |
| Antimonio | Sb |
| Argón | Ar |
| Arsénico | As |
| Ástato | At |
| Azufre | S |
| Bario | Ba |
| Berilio | Be |
| Berkelio | Bk |
| Bismuto | Bi |
| Bohrio | Bh |
| Boro | B |
| Bromo | Br |
| Cadmio | Cd |
| Calcio | Ca |
| Californio | Cf |
| Carbono | C |
| Cerio | Ce |
| Cesio | Cs |
| Cloro | Cl |
| Cobalto | Co |
| Cobre | Cu |
| Cromo | Cr |
| Curio | Cm |
| Darmstadio | Ds |
| Disprosio | Dy |
| Dubnio | Db |
| Einstenio | Es |
| Erbio | Er |
| Escandio | Sc |
| Estaño | Sn |
| Estroncio | Sr |
| Europio | Eu |
| Fermio | Fm |
| Flúor | F |
| Fósforo | P |
| Francio | Fr |
| Gadolinio | Gd |
| Galio | Ga |
| Germanio | Ge |
| Hafnio | Hf |
| Hassio | Hs |
| Helio | He |
| Hidrógeno | H |
| Hierro | Fe |
| Holmio | Ho |
| Indio | In |
| Iodo | I |
| Iridio | Ir |
| Iterbio | Yb |
| Itrio | Y |
| Kriptón | Kr |
| Lantano | La |
| Lawrencio | Lr |
| Litio | Li |
| Lutecio | Lu |
| Magnesio | Mg |
| Manganeso | Mn |
| Meitnerio | Mt |
| Mendelevio | Md |
| Mercurio | Hg |
| Molibdeno | Mo |
| Neodimio | Nd |
| Neón | Ne |
| Neptunio | Np |
| Niobio | Nb |
| Níquel | Ni |
| Nitrógeno | N |
| Nobelio | No |
| Oro | Au |
| Osmio | Os |
| Oxígeno | O |
| Paladio | Pd |
| Plata | Ag |
| Platino | Pt |
| Plomo | Pb |
| Plutonio | Pu |
| Polonio | Po |
| Potasio | K |
| Praseodimio | Pr |
| Prometio | Pm |
| Protactinio | Pa |
| Radio | Ra |
| Radón | Rn |
| Renio | Re |
| Rodio | Rh |
| Rubidio | Rb |
| Rutenio | Ru |
| Rutherfordio | Rf |
| Samario | Sm |
| Seaborgio | Sg |
| Selenio | Se |
| Silicio | Si |
| Sodio | Na |
| Talio | Tl |
| Tántalo | Ta |
| Tecnecio | Tc |
| Teluro | Te |
| Terbio | Tb |
| Titanio | Ti |
| Torio | Th |
| Tulio | Tm |
| Copernicio | Cn |
| Livermorio | Lv |
| Roentgenio | Rg |
| Ununoctio | Uuo |
| Ununpentio | Uup |
| Flerovio | Fl |
| Ununseptio | Uus |
| Ununtrio | Uut |
| Uranio | U |
| Vanadio | V |
| Wolframio | W |
| Xenón | Xe |
| Zinc | Zn |
| Zirconio | Zr |

Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)