En el ámbito de la química, se denominan bases (o hidróxidos) a las sustancias que al disolverse en agua liberan iones hidroxilo (OH–) y se denominan ácidos a las sustancias que son capaces de liberar protones (H+) en disolución acuosa. Por ejemplo: ácido sulfúrico, ácido nítrico, hidróxido de calcio, hidróxido de potasio.
- Puede servirte: Hidrácidos
Clasificación de ácidos y bases
Según su tendencia a la disociación en iones, los ácidos y las bases se clasifican en:
- Ácido fuerte. Es un ácido que se ioniza completamente en solución acuosa. Por ejemplo: HCl(ac), H2SO4(ac).
- Base fuerte. Es una base que se ioniza completamente en solución acuosa. Por ejemplo: NaOH(ac), KOH(ac).
- Ácido débil. Es un ácido que se ioniza parcialmente en solución acuosa, por lo que la concentración de sus iones en solución es menor que la de un ácido fuerte. Por ejemplo: el ácido carbónico (H2CO3).
- Base débil. Es una base que se ioniza parcialmente en solución acuosa, por lo que la concentración de sus iones en solución es menor que la de una base fuerte. Por ejemplo: amoníaco (NH3).
Los ácidos disminuyen el pH de las soluciones, las bases o álcalis lo elevan. Los ácidos fuertes a menudo son corrosivos, algunas sustancias se disuelven mejor en medios que han sido ligeramente acidificados o alcalinizados.
Ejemplos de ácidos
Algunos ácidos conocidos son:
- Ácido sulfúrico (H2SO4). Es un ácido fuerte con gran cantidad de usos, sobre todo en la industria pesada, muy corrosivo e irritante. Al diluirse libera mucho calor, por lo que debe manejarse (al igual que los demás ácidos fuertes) con sumo cuidado. Es intensamente oxidante.
- Ácido clorhídrico (HCl). Pese a que es un ácido fuerte, está presente en el cuerpo humano, concretamente en el estómago, donde cumple una importante función en el proceso digestivo. Su exceso genera acidez estomacal.
- Ácido fosfórico (H3PO4). Este ácido es un ingrediente común en las bebidas gasificadas. Se desaconseja el consumo habitual de tales bebidas por el impacto negativo de este ácido en el metabolismo del calcio, lo que afecta huesos y dientes sobre todo.
- Ácido nítrico (HNO3). Es un reconocido ácido fuerte, empleado para fabricar explosivos y fertilizantes nitrogenados, entre otros usos.
- Ácido perclórico (HClO4). Es un ácido fuerte, líquido a temperatura ambiente. Es uno de los más oxidantes.
- Ácido sulfhídrico (H2S). Es una sustancia gaseosa de fuerte y desagradable olor, tóxico en altas concentraciones. Tiene numerosas aplicaciones industriales.
- Ácido ribonucleico. Es un componente central de los ribosomas, fundamental para que se complete el proceso global de síntesis proteica a partir del ácido desoxirribonucleico.
- Ácido acetil salicílico. Es un ácido orgánico muy importante, con propiedades analgésicas y antiinflamatorias. Es la base de la aspirina.
- Ácido láctico. Proviene de la degradación de la glucosa durante el ejercicio anaeróbico de mucha intensidad y poca duración. En condiciones normales, este ácido láctico se reutiliza, pero si se acumula provoca daño en las fibras musculares, lo que produce calambres sobre todo.
- Ácido alílico. Es un ácido presente en vegetales como el ajo o la cebolla, derivado de un precursor también presente en tales especies, la alicina. Es germicida y antioxidante.
- Ácido retinoico. Aplicado tópicamente, inhibe la queratinización, se usa en cremas contra el acné y el envejecimiento de la piel. Debe usarse bajo vigilancia médica.
- Ácido butírico. Es el producto final de la fermentación de ciertos carbohidratos llevada a cabo por microorganismos del rumen. Suele formar parte de las grasas animales en pequeñas cantidades.
- Ácido propiónico. Es un conservante alimenticio, se usa con el fin de prevenir el deterioro fúngico y bacteriano de productos de panificación y otros.
- Ácido benzoico. Se usa como conservante adicionado a diferentes productos (mayonesas, productos enlatados), a menudo bajo la forma de sal (benzoato de sodio).
- Ácido acético (CH3COOH). Es un conservante de alimentos muy usado en el hogar, también como base de vinagretas y escabeches. Es el componente mayoritario del vinagre.
- Ácido yodhídrico (HI(ac)). Es un ácido fuerte que se puede utilizar para aumentar los niveles de yodo en las sales.
- Ácido succínico (C4H6O4). Es un sólido cristalino que puede obtenerse del ámbar. Puede generarse en el proceso de fermentación del vino y la cerveza.
- Ácido bromhídrico (HBr(ac)). Es un ácido fuerte muy corrosivo. Su reacción con bases es muy violenta, además es muy irritante. Se utiliza en la industria química y farmaceútica.
- Ácido cítrico (C6H8O7) Es un ácido orgánico abundante en las frutas. Es un antioxidante natural.
- Ácido oxálico (H2C2O4). Es un ácido orgánico que naturalmente se encuentra en las plantas. Se utiliza en la apicultura para controlar enfermedades en las abejas. También se utiliza para fabricar productos de limpieza, en la industria textil, entre otros usos.
- Más en: Ácidos
Ejemplos de bases
Se conoce a las bases de metales se las conoce genéricamente como hidróxidos. Algunas bases son:
- Hidróxido de sodio (NaOH, soda cáustica). Es una base fuerte que se utiliza en la industria papelera y en la fabricación de detergentes. En la vida cotidiana se usa para destapar cañerías de baños y cocinas.
- Hidróxido de magnesio (Mg(OH)2, leche de magnesia). Es una base fuerte que a veces se utiliza como antiácido o laxante.
- Hidróxido de calcio (Ca(OH)2, cal). También conocido como cal hidratada, se usa en la industria metalúrgica y petrolera. También se emplea para fabricar pesticidas, en la industria azucarera y láctea entre otras.
- Hidróxido de potasio (KOH). Es una base fuerte y corrosiva que se emplea mucho en diferentes industrias. Es muy utilizado para la fabricación de jabón.
- Hidróxido de bario (Ba(OH)2). Por su toxicidad, se utiliza para fabricar venenos. También se utiliza en la industria de la cerámica, en la industria papelera y en el proceso de refinar azúcar.
- Hidróxido de hierro II ó III (Fe(OH)2 ó Fe(OH)3). Suele generarse como parte de la industria metalúrgica. Se utiliza en la fabricación de pinturas entre otros usos.
- Amoníaco (NH3). Es un gas con un olor característico. Se utiliza para fabricar fertilizantes y muchos fármacos. Es muy peligroso si se inhala en dosis elevadas.
- Jabón. Es una sal de sodio o potasio. Se utiliza para la higiene personal y general.
- Detergente. También es un producto muy utilizado para la higiene.
- Quinina. Es una base natural producida por algunas plantas. Tiene propiedades antipiréticas y analgésicas. En tiempos antaños fue utilizada para tratar la malaria.
- Anilina. Es un compuesto tóxico al ser ingerido o inhalado. Se emplea en la industria del caucho, en la fabricación de herbicidas y explosivos, entre otros.
- Guanina. Es una de las bases nitrogenadas que forman parte de los ácidos nucleicos (ADN y ARN).
- Pirimidina. Las bases nitrogenadas que conforman los ácidos nucleicos son derivadas de la pirimidina.
- Citosina. Es una de las bases nitrogenadas que forman parte de los ácidos nucleicos.
- Adenina. Es una de las bases nitrogenadas que forman parte de los ácidos nucleicos.
- Hidróxido de zinc (Zn(OH)2). Es una sustancia anfótera (puede actuar como ácido y como base a la vez). Es una sustancia tóxica si está en contacto con los ojos o la piel. Se utiliza en el proceso de fabricación de apósitos quirúrgicos.
- Hidróxido de cobre (Cu(OH)2). Se utiliza como fungicida y para dar color a objetos de cerámica. También se emplea como catalizador de algunas reacciones químicas.
- Hidróxido de circonio IV (Zr(OH)4). Se utiliza en la industria cerámica y del vidrio.
- Hidróxido de berilio (Be(OH)2). Tiene propiedades anfóteras. Se utiliza en la industria para obtener berilio metálico. Es una sustancia de abundancia limitada.
- Hidróxido de aluminio (Al(OH)3, antiácido). Se utiliza en la medicina como antiácido y adyuvante de vacunas.
Teorías sobre ácidos y bases
El concepto de bases y ácidos ha ido variando con el tiempo. Fue Arrhenius quien elaboró la primera definición, que define a un ácido como una sustancia que en solución acuosa cede iones H+, y a una base como una sustancia que en solución acuosa cede iones OH–. Su teoría tenía algunas limitaciones, dado que ciertas sustancias (como el amoníaco) se comportan como bases sin tener en su molécula al ion hidroxilo.
Además, Arrhenius solo consideró las sustancias en medio acuoso, pero las reacciones ácido-base también se dan en otros medios de disolución no acuosos. Una representación de un ácido y una base según la teoría de Arrhenius es:
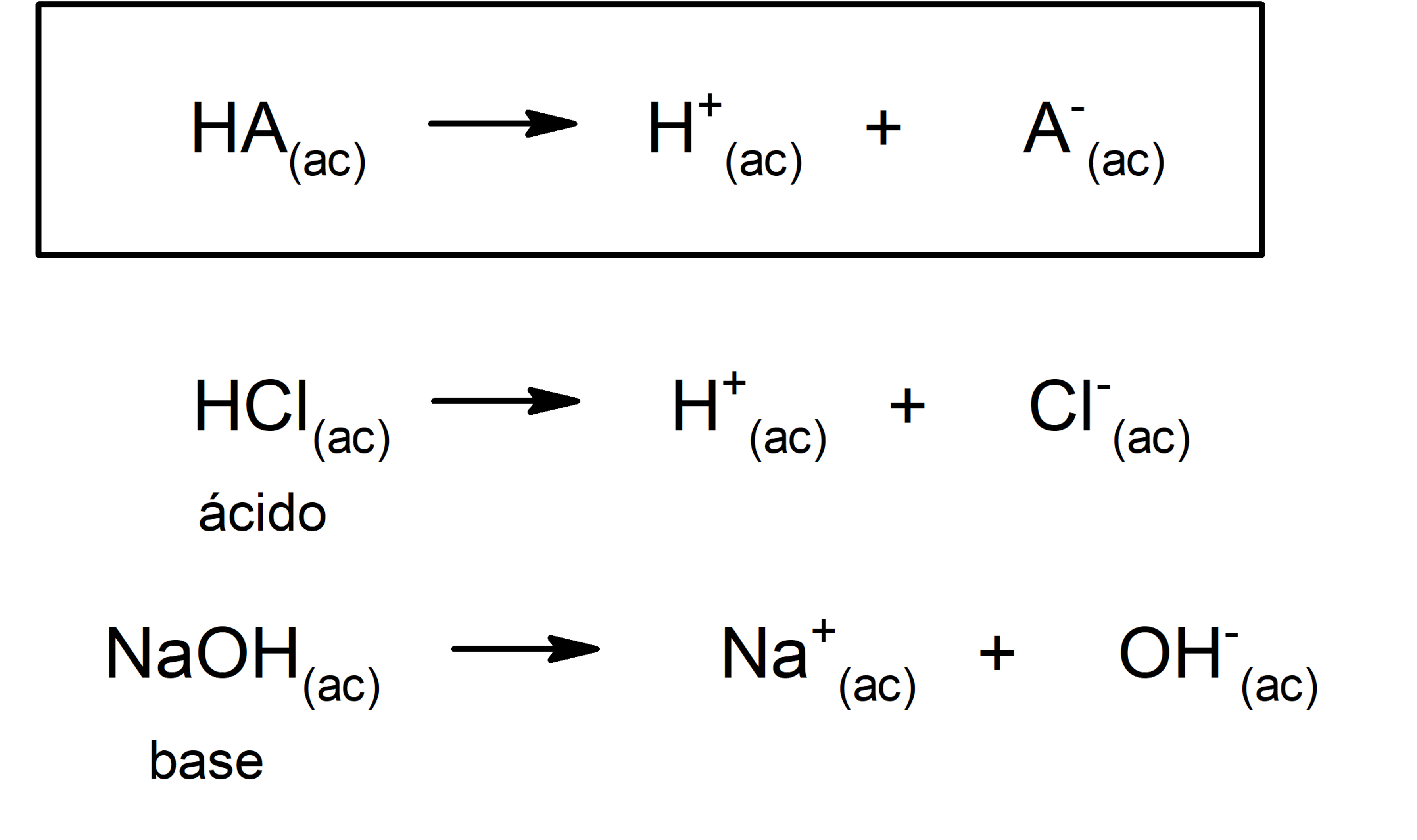
Casi cuarenta años después, hacia 1923, Brönsted y Lowry formularon otra teoría al plantear que los ácidos y las bases actúan como pares conjugados. Según esta teoría, el ácido es aquella sustancia capaz de ceder protones (en este caso no se refiere a los protones del núcleo atómico, sino a los cationes H+, siendo además H+ una abreviatura del catión H3O+) y la base es aquella sustancia capaz de aceptar esos protones.
Esta teoría plantea que en una reacción ácido-base, una base conjugada es la especie química que se forma después de que un ácido dona un protón, y un ácido conjugado es la especie química que se forma después de que la base acepta un protón. Esta teoría no es del todo completa, dado que existen varias sustancias que presentan propiedades ácidas sin disponer de átomos de hidrógeno ionizables en su estructura.
Pero por otro lado, en esta teoría no es obligatorio que las sustancias existan en solución acuosa. Una representación de un ácido (y su base conjugada) y una base (y su ácido conjugado) según la teoría de Brönsted – Lowry es la protonación del amoníaco, que no tiene que ocurrir en medio acuoso:
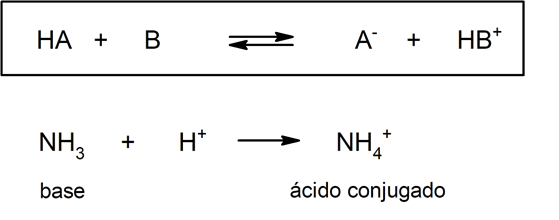
Por eso, como una parte adicional de su teoría sobre el enlace covalente, Lewis desarrolló una teoría en la que define a un ácido como toda aquella sustancia que puede aceptar un par de electrones, mientras que una base es toda sustancia capaz de ceder dicho par electrónico.
Según Lewis, los conceptos de ácido y base no involucran ganancia o pérdida de iones OH– y H+, sino que propone que el propio H+ es el ácido (puede aceptar electrones) y el OH- es la base (puede donar electrones). Una representación de una reacción ácido-base según la teoría de Lewis es:

Donde el OH- (que pertenece al NaOH) dona el par de electrones no compartido al H+ (que pertenece al HCl), como resultado se forma un enlace coordinado o dativo (enlace covalente en el que el par de electrones compartido es aportado por solo uno de los átomos involucrados en el enlace) para formar la molécula de agua.
Sigue con:
¿Te fue útil esta información?
Sí No¡Genial! gracias por visitarnos :)